1. Explica las funciones biológicas de las proteínas.
- Función de reserva–almacenamiento de sustancias de reserva: ovoalbuminas (clara de huevo).
- Funcion de transporte – citocromos: transporte de electrones. Hemoglobina transporte de oxígeno en sangre.
- Función contractil -actina y miosina :contracción muscular.
- Función protectora – trombina : evita la perdida de sangre.
- Transducción de señales -rodopsina : interviene en el impulso nervioso del proceso de la visión.
- Función hormonal – insulina y glucagón: regulan el nivel de glucosa en sangre.
- Función estructural - queratina : endurecer la epidermis (estrato córneo).
- Función enzimática – hidrolasas, liasas: llevar a cabo procesos catalíticos en el interior de la célula.
- Funciòn homeostática – mantiene el pH: presión osmótica.
- Función de reconocimiento de señales químicas – reconocer anticuerpos y virus.
2.¿Qué es la desnaturalización de las proteínas?. Tipos de desnaturalización y causas que las provocan.
Consiste en la rotura de los enlaces, perdiéndose las estructuras secundarias, terciarias y cuaternarias y pasa a adoptar una forma filamentosa. La desnaturalización puede estar provocada por cambios en el pH, la temperatura o por el tratamiento con sustancias desnaturalizantes. Al perder sus estructuras también pierden su actividad biológica. La desnaturalización puede ser reversible, es decir, la proteína pueden renaturalizarse recuperando la actividad biológica o irreversible, no puede volver a su conformación original.
3. Estructura general de un aminoácido. Concepto de péptido.
Los aminoácidos son compuestos sencillos de bajo peso molecular, que al unirse entre sí forman las proteínas. Químicamente, están compuestos por carbono, hidrógeno, oxígeno y nitrógeno.
Se caracterizan por poseer en su molécula un grupo carboxilo, un grupo amino y una cadena lateral o grupo R, todos ellos unidos covalentemente a un átomo de carbono (carbono alfa).
El grupo R determina sus propiedades químicas y biológicas. Son sólidos, solubles en agua, cristalizables, incoloros y con un punto de fusión alto, por encima de 200ºC.
Existen 20 aminoácidos proteicos que son los constituyentes de todas las proteínas, todos son L-alfa-aminoácidos.
Hay muchos más aminoácidos no proteicos que no forman parte de las proteínas.
Los aminoácidos se clasifican en función de su grupo R en:
Los aminoácidos presentan estereoisómeros:
Hay aminoácidos esenciales (8 en la especie humana): leucina, triptófano, valina......
Un péptido es una cadena que está constituida por la unión de menos de 100 aminoácidos. Cuando los aminoácidos forman cadenas, lo hacen mediante un enlace peptídico.
Este tipo de uniones son enlaces covalentes formados entre el grupo amino del primer aminoácido y el grupo carboxilo de segundo aminoácido.
4. Cita los tipos de enlaces que estabilizan la estructura terciaria de las proteínas.
Los tipos de enlace que estabilizan la estructura terciaria de una proteína son:
- Puentes de hidrógeno.
- Atracciones electrostáticas entre grupos con carga opuesta.
- Atracciones hidrofóbicas.
- Fuerzas de Van der Waals entre radicales alifáticos o aromáticos de las cadenas laterales.
- Puentes disulfuro entre restos de cisteína.
5. Haz una clasificación de las proteínas atendiendo a su función en los organismos. Cita un ejemplo de cada caso.
Holoproteínas: formadas exclusivamente por aminoácidos. Se clasifican en:
- Proteínas fibrosas: más sencillas; presentan enrollamiento en una sola dirección. Son insolubles en agua y tienen función estructural. Entre ellas se encuentran: el colágeno, la miosina, la queratina, la fibrina.
- Proteínas globulares: son más complejas; están totalmente plegadas . Son solubles en agua y son responsables de las actividades biológicas de las células. Entre ellas están: la actina, las albúminas, globulinas e histonas.
Heteroproteínas: presentan una parte proteica formada por aminoácidos y otra no proteica llamada grupo prostético. Según la naturaleza química de este grupo se clasifican en:
- Cromoproteínas: sustancias coloreadas como las porfirínicas y no porfirínicas.
- Nucleoproteínas: proteínas asociadas a ácidos nucleicos como protaminas e histonas.
- Glicoproteínas: el grupo prostético es un glúcido como las inmunoglobulinas, fibrinógeno.
- Fosfoproteínas: el grupo prostético es una ácido fosfórico como la caseína, vitelina.
- Lipoproteínas: el grupo prostético es un lípido como las LDL (deposita en las paredes de los vasos sanguineos), HDL (limpia las paredes de los vasos sanguíneos).
6. Define el concepto de proteína y péptido. Menciona los principales elementos constituyentes de las proteínas simples.
Las proteínas son las moléculas orgánicas más abundantes en las células y constituyen el 50% o más de su peso seco. Se encuentran distribuidas por toda la célula y son fundamentales tanto estructural como funcionalmente. Están constituidas por 20 alfa-L-aminoácidos. Cuando el número de aminoácidos es superior a 100 se llama proteína. Si el número es inferior a 100 se le llama péptido.
Los péptidos son un tipo de moléculas formadas por la unión de varios aminoácidos mediante mediante enlaces peptídicos. Al igual que las proteínas, están presentes en la naturaleza y son responsables de un gran número de funciones.
Las proteínas están formadas por cadenas lineales de aminoácidos. En el caso de las proteínas simples están compuestas básicamente de C, H, O, N y S . En las proteínas complejas además de otras biomoléculas pueden contener : P, Fe, Cu, Zn y Mg.
7. ¿Qué es una proteína conjugada?. Nombra algunos ejemplos.
Las proteínas “conjugadas” o “Heteroproteínas” son proteínas que al hidrolizarse liberan, además de los aminoácidos, otros componentes orgánicos o inorgánicos. La porción no proteica de una proteína conjugada se denomina “grupo prostético”.
Las proteínas conjugadas se subclasifican de acuerdo con la naturaleza de sus grupos prostéticos.
Algunos ejemplos son :
proteina conjugada: grupo prostetico Ejemplos
Lipoproteínas lípidos lipoproteína HDL y LDL
Glicoproteínas carbohidratos inmunoglobulina G
Fosfoproteínas grupo(s) fosfato caseina de la leche
Cromoproteínas (porfirina de Fe) hemoglobina
Nucleoproteínas ácido nucleico histonas y protaminas
8. Define el concepto de enzima e indica su naturaleza química.
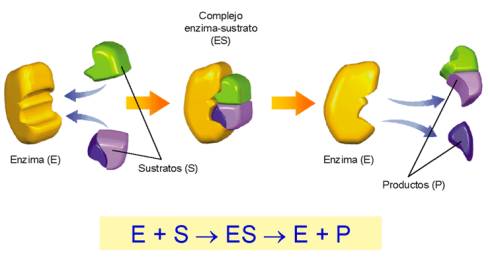
Los enzimas son generalmente proteínas que catalizan de forma específica determinadas reacciones bioquímicas y se unen a la molécula o metabolito que se transformará en substrato.
La región del enzima donde se acomoda el substrato es el centro activo. La unión de enzima y substrato implica un reconocimiento estéreo espacial y se unen de forma específica, por eso hay una gran variedad de enzimas a causa de su especificidad
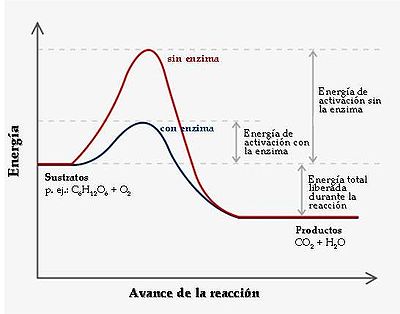
Los enzimas disminuyen la energía de activación y aceleran las reacciones bioquímicas, no cambian el signo ni la cantidad de la variación de la energía libre, no modifican el equilibrio y cuando acaba la reacción, quedan libres para funcionar otras veces.
Sus características son::
- Disminuyen la energía de activación del proceso en que intervienen, es decir, aceleran las reacciones bioquímicas.
- No cambian el signo ni la cantidad de la variación de la energía libre, sólo aumentan la velocidad.
- No modifican el equilibrio de una reacción, sino que aceleran la llegada a este equilibrio.
- Cuando acaba la reacción, quedan libres y sin alterarse como cualquier otro catalizador y pueden funcionar otras veces.
- Son enormemente específicos. Los enzimas sólo se unen a un tipo de substrato. El modelo de unión es el de ma - guant. La conformación del centro activo del enzima se adapta a la estructura del substrato que reconoce.
9. Explica los tipos de inhibición competitiva y no competitiva.
INHIBIDOR COMPETITIVO
Un inhibidor competitivo posee una semejanza estructural con el sustrato y ambos entran en competencia por unirse al mismo sitio del enzima. La reacción es bloqueada ya sea porque el inhibidor carece del grupo químico sobre el que actúa el enzima o bien porque impide la fijación del sustrato al enzima.
INHIBIDOR NO COMPETITIVO
Un inhibidor no competitivo puede unirse tanto al enzima libre como al enzima ligado al sustrato, en ambos casos con la misma afinidad.
Sin embargo, inhibidor y sustrato no entran en competencia por unirse sobre un mismo sitio. El sustrato se liga al sitio activo y el inhibidor a otro sitio.
El inhibidor modifica la conformación del sitio activo obstaculizando la transformación del sustrato en producto, pero no afecta el reconocimiento entre enzima y sustrato (en la mayor parte de los casos, los enzimas se denominan alostéricos).
10. ¿Cuáles son los factores que influyen en la actividad enzimática y cómo la afectan?
Hay varios factores: pH i Temperatura.
Las variaciones de temperatura inducen a cambios conformacionales en la estructura terciaria o cuaternaria de los enzimas, alteran sus centros activos y por tanto su actividad biológica. Cada enzima tiene una temperatura y un pH óptimos para actuar, de manera que su actividad disminuirá sensiblemente, o incluso, desaparecerá cuando los valores de las dos variables se alejan de los valores óptimos. La mayoría de los enzimas actuan a la temperatura de los seres vivos y se inactivan a temperaturas superiores a 50-60ºC.
Las variaciones de pH del medio provocan un cambio en las cargas eléctricas superficiales de los enzimas, hecho que altera su estructura terciaria y por tanto, su actividad. Cada enzima actúa a un pH óptimo. Así pues, por ejemplo, los enzimas intestinales tripsina o quimiotripsina actuan a un pH óptimo ligeramente alcalino. Los deshidrogenados tienen un pH óptimo de 7,5 mientras que la pepsina del estómago actúa a un pH ácido.
11. Define coenzima. Tipos.
Una coenzima es una pequeña molécula orgánica compleja que se une a una enzima débilmente, y que es esencial para su actividad, pero que no se modifica al término del proceso catalítico. La mayor parte de las coenzimas derivan de las vitaminas y cada tipo de coenzima tiene una función bioquímica concreta.
- NAD + y NADP + deshidrogenasas, intervienen en procesos de óxido-reducción.
- Coenzima A, transportador de grupos acil R-CO-. Un derivado de este coenzima - el acetil-CoA- es de gran importancia en el metabolismo celular.
- FAD deshidrogenasa, interviene en procesos de óxido-reducción.
12. Explica los niveles estructurales de las proteínas.
La organización de una proteína viene definida por cuatro niveles estructurales denominados:
- estructura primaria,
- estructura secundaria
- estructura terciaria
- estructura cuaternaria.
Cada una de estas estructuras informa de la disposición de la anterior en el espacio.
Estructura primaria es la secuencia lineal de aminoácidos de la proteína. Nos indica qué aminoácidos componen la cadena polipeptídica y el orden en que dichos aminoácidos se encuentran. La función de una proteína depende de su secuencia y de la forma que ésta adopte.
El enlace que presenta es el peptídico.
Estructura secundaria es la disposición de la secuencia de aminoácidos en el espacio. Los aminoácidos, a medida que van siendo enlazados durante la síntesis de proteínas y gracias a la capacidad de giro del C alfa de sus enlaces, adquieren una disposición espacial estable.
Pueden presentarse las siguientes estructuras:
- Alfa hélice: Los aminoácidos en una hélice α están dispuestos en una estructura helicoidal dextrogira, con unos 3,6 aminoácidos por vuelta. Cada aminoácido supone un giro de unos 100° en la hélice. Todas las cadenas laterales de los aminoácidos están dispuestas hacia el exterior de la hélice.
El grupo N-H del aminoácido (n) puede establecer un enlace de hidrógeno con el grupo C=O del aminoácido (n+4). De esta forma, cada aminoácido (n) de la hélice forma dos puentes de hidrógeno con su enlace peptídico y el enlace peptídico del aminoácido en (n+4) y en (n-4). En total son 7 enlaces de hidrógeno por vuelta. Esto estabiliza enormemente la hélice.
LOS POLIPÉPTIDOS CORTOS HABITUALMENTE NO SON CAPACES DE ADOPTAR LA ESTRUCTURA DE HÉLICE ALFA, YA QUE EL COSTE ENTRÓPICO ASOCIADO CON EL PLEGAMIENTO DE LA CADENA POLIPEPTÍDICA ES DEMASIADO ALTO.
- LA ESTRUCTURA BETA U HOJA PLEGADA ES UNA DE LAS ESTRUCTURAS SECUNDARIAS POSIBLES ADOPTADA POR LAS PROTEÍNAS. SE FORMA POR EL POSICIONAMIENTO PARALELO DE DOS CADENAS DE AMINOÁCIDOS DENTRO DE LA MISMA PROTEÍNA, EN EL QUE LOS GRUPOS N-H DE UNA DE LAS CADENAS FORMAN ENLACES DE HIDRÓGENO CON LOS GRUPOS C=O DE LA OPUESTA


Estructura terciaria informa sobre la disposición de la estructura secundaria de un polipéptido al plegarse sobre sí misma, originando una conformación o bien globular o fibrosa.
En definitiva, es la estructura primaria la que determina cuál será la secundaria y por tanto la terciaria.
La conformación globular facilita la solubilidad en agua y así realizar funciones de transporte, enzimáticas, hormonales, etc. Esta conformación globular se mantiene estable gracias a la existencia de enlaces entre los radicales R de los aminoácidos y las fuerzas que intervienen son:
- puentes de hidrógeno
- interacciones electrostáticas entre grupos de carga opuesta
- atracciones hidrofóbicas entre radicales alifáticos
- fuerzas de Van der Waals entre grupos aromáticos
- puentes disulfuro entre aminoácidos con grupos tiol (-SH)
Estructura cuaternaria informa de la unión, mediante enlaces débiles (no covalentes) y covalentes (puentes disulfuro) de varias cadenas polipeptídicas con estructura terciaria, para formar un complejo proteico.
Cada una de estas cadenas polipeptídicas recibe el nombre de protómero.
El número de protómeros varía desde dos, como en la hexoquinasa; cuatro, como en la hemoglobina, o muchos, como la cápsida del virus de la poliomielitis, que consta de sesenta unidades proteicas.
Los enlaces que intervienen para estabilizar la estructura son los mismos que en la terciaria pero entre radicales de cadenas distintas
13. Enumera, al menos, cuatro funciones biológicas de las proteínas y pon un ejemplo de cada caso.
- Función de reserva: ovoalbúmina y casina.
- Función estructural: glicoproteínas, histonas, tubulina, colágeno, queratina y elastina.
- Función transportadora: lipoproteínas, hempglobina, citocromos, mioglobina, hemocianina y seroalbúmina.
- Función contráctil: actina, miosina, dineina y flagelina.
- Función protectora o defensiva: inmunoglobulinas o anticuerpos.
- Función hormonal: insulina, glucagón, somatotropina 8Hormona del crecimiento).
- Función enzimática: hexoquinasa, rubisco, etc.
- Función homeostática.
- Función de reconocimiento de señales.
14.- ¿Cuándo se considera que un aminoácido es de la serie D o de la serie L?
Un aminoácido es de la serie D cuando, estando la molécula convenientemente orientada, el grupo amino queda a la derecha del observador. Es de la serie L cuando dicho grupo queda a la izquierda. El grupo carboxilo unido al carbono alfa debe estar arriba, y los sustituyentes H y amino, en el plano horizontal, dirigidos hacia el observador.
Las formas D y L de un mismo aminoácido son imágenes especulares (enantiómeros).

Todas las proteínas de los seres vivos están integradas por aminoácidos de la serie L, pero existen D-aminoácidos en el peptidoglucano (mureína) de las paredes celulares bacterianas.
15.- Formular: D-alanina (R=−CH3) y L-cisteína (R=−CH2SH).

16.- Clasificación de los aminoácidos.
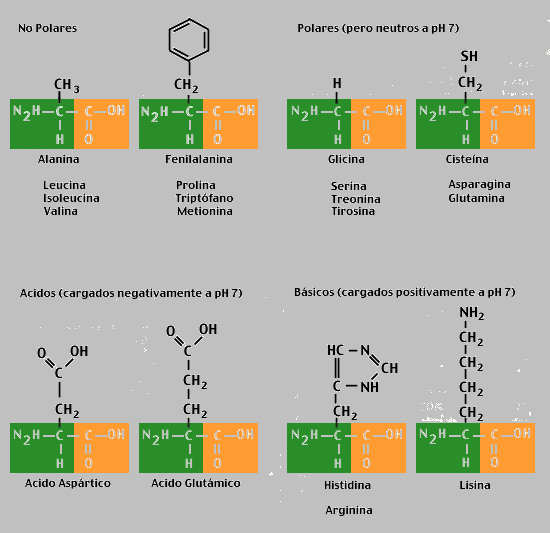
Los aminoácidos pueden clasificarse según la polaridad de sus grupos R (radicales):
• Neutros polares. El radical contiene enlaces covalentes polares. No tienen carga eléctrica neta, pero presentan afinidad por el agua. Son 7, por ejemplo: serina (Ser), cisteína (Cys), treonina (Thr).
• Neutros no polares. El radical sólo contiene enlaces covalentes apolares, por lo que es hidrofóbico. Son 8, por ejemplo: alanina (Ala), valina (Val), leucina (Leu).
• Ácidos. El radical lleva un grupo ácido (-COOH), de forma que a pH neutro tiene carga neta negativa. Son 2: aspártico (Asp) y glutámico (Glu).
• Básicos. El radical lleva un grupo básico (amino), por lo que a pH neutro tienen carga eléctrica positiva neta. Son 3: lisina (Lys), histidina (His) y arginina (Arg).
19.- (Consulte su libro). Formular los aminoácidos "Asp" y "Lys" a pH 7 (neutro). ¿Cuál es la carga eléctrica neta?
• “Asp” corresponde al ácido aspártico (aspartato). A pH 7 tiene carga neta 1–.
• “Lys” corresponde al aminoácido básico llamado lisina. Su carga eléctrica neta a pH 7 es 1+.

20.- ¿Qué significa el término anfótero?
Anfótero significa que los aminoácidos pueden actuar como ácidos y como bases, dependiendo del pH.
En medios acuosos y a pH 7 (neutro) el grupo carboxilo, por su carácter ácido, cede un protón (H+) y adquiere carga negativa, mientras que el grupo amino, por su carácter básico, lo capta y queda con carga positiva.

Si el pH es muy ácido, el grupo COO- incorpora un protón (H+) y desaparece la carga negativa (COOH). Cuando el pH se vuelve muy básico, el grupo amino cede un protón y desaparece la carga positiva (NH2).
En el esquema siguiente se observa la forma dipolar iónica a pH neutro de muchos aminoácidos.

21.- Una de las propiedades más notables de los aminoácidos es su efecto amortiguador o tampón. ¿Qué quiere decir eso? ¿Qué es el punto isoeléctrico?
• Que debido a su comportamiento anfótero, los aminoácidos tienden a mantener constante el pH del medio.
Si se acidifica el medio en el que se encuentra la forma dipolar, el grupo carboxilo ionizado (COO−) capta protones (H+) y amortigua dicha acidificación (COOH).
Si aumenta el pH del medio en el que se encuentra la forma dipolar, el grupo amino ionizado (H3N+) libera protones (H+) y amortigua la alcalinización.
• Se llama punto isoeléctrico al valor del pH en el cual un aminoácido adopta la forma dipolar neutra, esto es, presenta tantas cargas positivas como negativas.
25.- Aclare el significado de la siguiente expresión (AA = aminoácido):

• La expresión puede significar que a pH neutro el aminoácido existe en la forma de ion dipolar (+AA−). En este caso, dado que la carga neta es cero, el aminoácido no se desplazaría sometido a la acción de un campo eléctrico.
• Al disminuir el pH del medio (acidificación) cambiaría a la forma catiónica (AA+). Si el pH va aumentando (alcalinización), el aminoácido adoptaría la forma aniónica (AA−).
28.- ¿Son moléculas eléctricamente neutras los aminoácidos a pH neutro?
Depende del grupo R, pues a pH neutro tanto el grupo amino como el carboxilo unidos al carbono alfa están ionizados y presentan carga + y − respectivamente. Por consiguiente, la molécula será neutra si R carece de carga, pero en el caso de los aminoácidos ácidos (R−) o básicos (R+), la carga eléctrica neta será negativa o positiva. O sea:

29.- (Consulte su libro). Escriba la fórmula del aspártico (aspartato) a pH: muy ácido (≈1), neutro y muy básico (≈13).

Debido al carácter ácido del radical del aspártico (R−), la carga neta a pH neutro es negativa.
30.- (Consulte su libro). Escriba la fórmula de la lisina a pH: muy ácido (≈1), neutro y muy básico (≈13).

Debido al carácter básico del radical de la lisina (R+), la carga neta a pH 7 es positiva.
31.- ¿Qué son aminoácidos esenciales y semiesenciales? Cítelos.
Mediante la fotosíntesis las plantas son capaces de sintetizar los 20 aminoácidos proteinógenos a partir de compuestos inorgánicos, pero los animales y otros seres heterótrofos necesitan tomar algunos de esos 20 con la dieta al ser incapaces de sintetizarlos.
• Los aminoácidos esenciales son aquellos que no puede sintetizar un organismo y debe tomarlos con los alimentos. En la especie humana hay 8 que son esenciales: fenilalanina, isoleucina, leucina, lisina, metionina, treonina, triptófano, valina.
• Los aminoácidos semiesenciales son aquellos que, sin ser esenciales, pueden llegar a serlo en determinadas circunstancias, como la histidina, cisteína y tirosina en niños prematuros, y la arginina en situaciones de grandes requerimientos.














Cap comentari:
Publica un comentari a l'entrada